شيشه و شيشه سازي
شيشه ها در سراسر عمر زمين با سرد شدن سريع ماگماها وگدازه ها تشكيل شده اند. بهترين مثال در اين زمينه ،شيشه ابزيدين (1) است كه در ساخت پيكان هاي نوك تيز و وسايل برش مورد استفاده قرار مي گرفت. شيشه هايي با تركيب شيميايي متفاوت ،از ماه و شهابسنگها نيز بدست آمده است و از اين راه مي توان اطلاعات مهمي راجع به پيدايش سيستم خورشيدي بدست آورد .
اگر چه تاريخچه ساخت شيشه روشن نيست، ولي احتمالاً اولين بار در3000سال پيش ، در مصر توليد شد كه از آن در وسايل تزئيني استفاده مي نمودند. تكنيكهاي دميدن توسط رومي ها توسعه يافت و وسايل شيشه اي رايج شدند . از آن پس شيشه سير تكاملي خود را از يك شئ كم مصرف تزئيني ، به ماده اي با مصارف گوناگون طي نمود . اين تكامل تدريجي مديون اختراعات علمي و گروه هاي متعدد محققين ، در سطوح مختلف مي باشد.
با وجود اينكه شيشه كاربردي عمومي يافته است محققين بر روي يك تعريف رضايتبخش براي آن توافق ندارند . متداولترين ترين تعريف به اين صورت است كه « شيشه يك محصول معدني مذاب است كه بر اثر سرد شدن ، بدون آنكه بلوري شود ، به حالت جامد در مي آيد.» اما اين توصيف چندان رضايت بخش نيست چرا كه شيشه هاي آلي را در بر نمي گيرد. در ضمن شيشه ها با روش هاي مختلفي مانند تبخير محلول و ته نشيني بخار ، ساخته مي شوند. با اين حال تعريف فوق در اكثر موارد صادق است. شيشه هاي طبيعي عموماً غني از سيليسيم مي باشند و مقادير زيادي از ساير فلزات نظير Fe ,Na ,K ,Ca ,Mg وAl كه همه آنها با اكسيژن همراه هستند،را شامل مي شوند. شيشه هاي تجارتي مشابه هم هستند و معمولاً از ذوب كردن مخلوطهايي از SiO2 و ساير اكسيد هاي معدني ، در دماي بالا، ساخته مي شوند. معمولا اين قبيل شيشه ها، با استفاده از مواد شيميايي ومعدني به عنوان منبع پخت ، درتانكهاي حرارتي بزرگ الكتريكي ،نفتي ياگاز سوز ،ذوب مي شوند .واحدهاي ذوب اغلب پيوسته است واز يك طرف ، به كوره وارد شده واز طرف ديگر شيشه مذاب به طور پيوسته، خارج شده و به شكل مورد نظر تبديل مي شود، شكل دهي با يكي از روشهاي زير صورت مي گيرد :
دميدن ،فشردن ، ريخته گري درون قالبها ، بيرون راندن از روزنه هاي مخصوص و غيره . در فرايند شناور سازي پيلكينگتون ، نوار باريكي از شيشه مذاب ،بر سطح حمامي ازقلع مذاب براي هموار كردن تمام نا همواريهاي سطح آن،به مدت كافي شناور ميشود .اكثر صفحات شيشه اي ،در دنيا به روش شناور سازي ساخته مي شوند .
ساختار شيشه
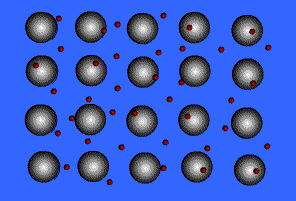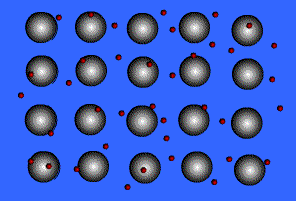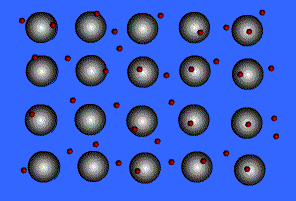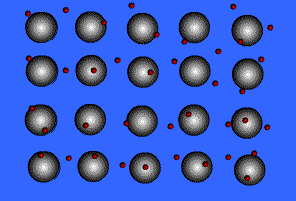
به آساني مي توان ساختار يك شيشه ساده را در ذهن تصور نمود . نمودار ساده اي از شيشه هاي SiO2 خالص و SiO2 بلوري(كوارتز) در شكل - 1 نمايش داده شده است . هر دو ماده حاوي اتم هاي سيليسيم هستند كه در يك ساختار چهار وجهي با چهار اتم اكسيژن پيوند برقرار كرده اند . ماده بلوري داراي نظمي با ابعاد گسترده تر مي باشد . از نظر تئوري، دانستن موقعيت يك سلول واحد در بلور، مي تواند براي پيشگويي موقعيت كليه اتم هاي ديگر مورد استفاده قرار گيرد. اگرچه شيشه، گاهي در ابعاد بيش از چند قطر اتمي ساختار منظمي دارد، ولي در ابعاد بيشتر نظمي ندارد .
شكل 1
(a) ساختار بلوري SiO2
(b طرحواره اي از ساختار شيشه SiO2
(c) چهار وجهي نشان داده شده در قسمت هاي و نمايش دهنده يك اتم سليسيم
(دايره تو پر ) به همراه چهار اتم اكسيژن (كره هاي تو خالي بزرگ) مي باشند .
شيشه SiO2 خواص مطلوب زيادي از قبيل پايداري شيميايي فوق العاده،توانايي مقاومت در مقابل تغييرات زياد و ناگهاني
دما و قابليت عبور نور در گستره وسيعي از طول موج را دارا مي باشد. متأسفانه ، ويسكوزيتــه و نقطه ذوب SiO2 بسياربالا است (ºC 1723) و اين مطلب ساختن شكلهاي قابل استفاده از آن را مشكل مي سازد.به همين دليل شيشه SiO2را به سختي ميتوان از مذاب آن ساخت . روش پايين آوردن نقطه ذوب و ويسكوزيته شيشه SiO2 ، وارد نمودن تعديل كننده هاي شبـــكه (اتم هايي كه شبكه Si-O-Si را مي شكنند)، مي باشد .درشكل- 2 اثر افزايش Na2O – نوعي تعديل كننده – نمايش داده شده است. با شكستن شبكه ، ويسكوزيته ودماي ذوب آن پايين مي آيد و دردماي مناسب، به شكلهاي قابل استفاده اي تبديل مي شود.
اكثر عناصر جدول تناوبي نيز مي توانند در شيشه هاي سنتزي بعنوان يك تشكيل دهنده و تعديل كننده شبكه وارد شوند. با تغيير تركيب شيميايي موادي كه در ساخت شيشه به كار مي رود ، مي توان خصوصيات فيزيكي و شيميايي زيادي را در مواد شيشه اي ايجاد نمود. به همين دليل كاربردهاي كنوني شيشه ، گستره اي از شيشه ساده (شيشه هاي پنجره اي و بطري) تا شيشه هاي پيچيده(ارتباطات راه دور ، صفحات بلور – مايع، ليزرها ، پروتزهاي پزشكي و محاسبات نوري)را در بر مي گيرد .
شكل 2- افزايش Na2O به شيشه , شبكه بلوري آن را در هم ريخته و مانند ذوب شدن با دماي بالا , از ويسكوزيته آن مي كاهد
شيمي شيشه هاي معمولي
اگر چه پرداختن جديدترين كاربرد هاي شيشه جالب است .شيمي اشياء شيشه اي ساده و عادي ميتواند بطور فريبنده اي پيچيده و جالب باشد. متداولترين تركيبي كه در سراسر دنيا براي شيشه بكار مي رود ، مخلوطي از Na2O ، CaO و SiO2
به همراه مقادير كمي از ساير اكسيدها مي باشد . اين نوع شيشه را شيشه آهكي مي نامند . شيشه آهكي نسبت به ساير شيشه ها مزايايي دارد :
• سازنده هاي آن ارزان و متداولند
• به هنگام سرد شدن متبلور نمي شود
• در دماهاي نسبتأ پايين (حدود ºC1300 ) ذوب مي شود
• در برابر عوامل خوردگي جوي مقاوم است
در نتيجه بطري ها ، شيشه هاي مربا ، شيشه پنجره ها ، لامپ روشنايي و لامپهاي فلورسنت معمولاً از شيشه آهكي ساخته مي شوند .
در ضمن شيشه آهكي را مي توان به آساني رنگ كرد. براي مثال ، افزودن غلظتهاي كمي از يونهاي فلزات واسطه ، سبب جذب نور در ناحيه مرئي طيف مي شودكه به علت انتقالات الكترونهاي 3d مي باشد . مثلاً رنگ سبزي كه در لبه شيشه پنجره ها ديده مي شود ناشي از وجود مقادير كم Fe 2+ مي باشد. ساير رنگ كننده ها عبارتند از Co2+ , براي رنگ آبي ، Mn3+ براي رنگ ارغواني و Cr3+ براي رنگ سبز . از آنجاييكه انتقالات درالكترونهاي 3d اتفاق مي افتد ، رنگهاي حاصل بستگي به محيط اطراف يونها دارد . به همين دليل ، رنگها اغلب با تغيير در تركيب شيشه ها ، تغيير مي كنند . در هر صورت عناصر خاكهاي نادر نيز مي توانند در شيشه هاي رنگي مورد استفاده قرار گيرند كه انتقالات الكتروني آنها در اوربيتالهاي داخلي تر انجام مي پذيرد. بنابراين، انتقالات آنها تحت تأثير محيط اطراف يون قرار نمي گيرد و رنگ حاصل به تركيب شيشه بستگي نخواهد داشت .
اما يكي از معايب شيشه آهكي ، عدم پايداري آن است. عموماً شيشه را بعنوان ماده بي اثر در نظر مي گيرند ولي خيلي از شيشه ها ازنظر شيميايي فعال هستند . شكلهاي متعددي از اين قبيل واكنشها وجود دارد كه دو مورد مهم آنها به قرار زير است :
در محلولهاي اسيدي ، تعويض يونهاي H+ مجاور سطح شيشه با يونها قليايي داخل شيشه به آساني انجام مي پذيرد . معمولاً اين تعويض يون سبب تشكيل يك لايه محلول رنگين كماني بر شيشه مي شود . بر عكس ، در معرض يك محلول قليايي ، ساختار شيشه با وارد شدن يونها ي OH- در هم شكسته مي شود و در نهايت منجر به انحلال كامل شيشه مي گردد. تشكيل لايه سفيد نازكي بر روي سطح ظروف شيشه اي، پس از آنكه مدت زيادي در معرض شوينده ها قرار ميگيرد ، مثال به خوبي شناخته شده اي از فرايند اخير مي باشد .
شيشه هاي آهكي در مقابل دماهاي زياد با تغييرات ناگهاني حرارت نيز زياد مقاوم نيستند . بدليل انبساط حرارتي زياد (تغيير ابعاد با دما)شيشه آهكي، تغييرات ناگهاني دما سبب ايجاد فشارهاي ناخواسته در شيشه وشكاف برداشتن ياشكستن آن مي شود .
يك راه حل براي اين قبيل مسائل ، توسعه شيشه هاي بوروسيليكات است. يك مثال از شيشه هاي بوروسيليكات مقاوم حرارتي و پايدار، شيشه پيركس است. بوروسيليكاتها گستره وسيعي از كالاهاي خانگي مصرفي را در برميگيرند. افزايشB2O3 به تركيب شيميايي شيشه دو مزيت دارد . يكي اينكه انبساط گرمايي را تا 50% كاهش ميدهد و درنتيجه مقاومت هر شئ را دربرابرشوكهاي گرمايي بالامي برد دوم اينكه پايداري شيشه بطورمحسوسي بالا مي رود. علل افزايش پايداري شيميايي در بوروسيليكاتها روشن نيست . يك نظر رايج اين است كه با سرد شدن شيشه يك فاز غير قابل اختــلاط بوجود مي آيد، يك فاز ناپيـــوسته غني از Na2O و B2O3 و يك فاز پيوشته غني از SiO2 . پايداري شيشه بدون از دست دادن توانايي تشكيل شيشه در دماهاي معقـول تقويت مي شود . از آنجا كه قطر فاز ناپيوسته كاملاً زير طول موج نور مرئي است ، شفافيت اين ماده محفوظ است.
از اين پديده مي توان براي توليد گروه معروف ديگري از شيشه ها يعني شيشه هاي شيري رنگ استفاده كرد. بسياري از شيشه ها به گونه اي طراحي شده اند كه به صورت دو فاز جدا مي شوند و ريخت (مورفولوژي)آنها طوري است كه شكست و پراكندگي دروني نور، ماده اي نيم شفاف يا مات به وجود مي آورد. هر دو فاز مي توانند شيشه باشند ، يا در مواردي يك فاز ميتواند بلوري باشد. از شيشه هاي شيري رنگ در ساخت بعضي از ظروف آشپزي نيم شفاف و بشقابهاي سفيد غذا خوري استفاده مي شود.
تركيبهاي استاندارد ديگري براي شيشه وجود دارد . آلومينو سيليكاتها خواصي مشابه بوروسيليكاتها دارند اما مي توانند دماهاي بالاتري را تحمل كنند. شيشه هاي سربي با توجه به دارا بودن خواصي از قبيل : ضريب شكست بالا، دماي ذوب پايين ، سادگي شكل پذيري و مقاوم بودن در مقابل تابش هاي پر انرژي ، كاربرد وسيعي دارند . از دو خاصــيت اول درساخت شيشــه هاي صنعتي، شيشه هاي تزييني و نوري و از خاصيت سوم در پنجره هاي تابشي و لامپ هاي تلوزيون و … استفاده مي شود . شيشه هاي كه از افزايش بورات ، فسفات ، ژرمنات و كالكوژنيد بدست مي آيند ، نيز كاربرد تجارتي دارند .
شيشه – سراميك ها
شيشه – سراميك ها بين شيشه ها و سراميك ها ي بلوري ، پلي ايجاد مي كنند . شيشه – سراميك ها به بهترين شكل به صورت » جامدهاي ريز بلوري كه با تبـــلور كنترل شده شيشه بوجود آمده اند « تعريف ميشوند . شيشه ها با استفاده از تكنيــكهاي استاندارد ذوب شده و شكل مي پذيرند و سپس با عمليات حرارتي ويژه اي ، بلور دانه اي يكنواختي تشكيــل ميشود . معمولاً 50% حجمي شيشه – سراميك ها بلوري است و آنها را بادرجه بلوري شدن از شيشه هاي مات تشخيص مي دهند. خواص ويژه شيشه – سراميك ها توسط خواص فيزيكي تك بلورها و بوسيله رابطه بين بافت بلورها و شيشه باقي مانده كنترل مي شود . به همين دليل شيشه – سراميك ها داراي خواص گوناگوني از قبيل : استحكام ، قابليت ماشين كاري و پايداري در برابر تغييرات حرارتي مي باشند . (شكل 3 )
شكل 3-(a) β – ميكروگراف الكتروني عبوري شيشه – سراميك كوارتز پر شده , كه درجه تبلور اين مواد را نمايش مي دهد
(b) ميكروگراف الكتروني عبوري شيشه – سراميك فلورميكا
نمونه اي از اين پديده ، ويژنز (2) محصول كورنينگ است (3) كه از شيشه Li2O - Al2O3 - SiO2 كه مقاديـــر كمي از TiO2 و ZrO2 دارد تحت تاثير گرما ساخته مي شود. تحت تاثير گرما بلورهايي از زيركونيم تيتانات از شيشه رسوب مي كند و محلهاي هسته زايي را براي رشد بلورهاي ليتيم آلومينوسيليكات از شيشه فراهم ميكنند . از آنجا كه انبساط گرمايي بلورهاي ليتيم آلومينوسيليكات بطور استثنائي پايين است ، اين شيشه – سراميك ها مي توانند تغييرات ناگهاني دما را در ارتباط با ظروف خوراك پزي تحمل كنند . در ضمن به دليل اينكه اندازه هر بلور كوچكتر از طول موج نور است و ضريب شكست اين بلورها و شيشه با يكديگر همخواني دارد پراكندگي نور صورت نمي گيرد و اين مواد شفاف به نظر ميرسند .
الياف نوري
بالاخره ، يكي از ساده ترين شيشه ها (SiO2 خالص) در يكي از مهمترين محصولات شيشه اي يعني هدايت كننده هاي نوري براي ارتباطات راه دور مورد استفاده قرار مي گيرد .اين قبيل الياف نياز به خلوص خيلي بالايي براي عبور نور در بيش از دهها كيلومتر دارند .در اين مواد بايد از ناخالصي هايي ماننـــد فلزات واسطه يا H2O محلول ، حتي به ميزان يك بيليونيم نيز اجتناب نمود ، زيرا اين مواد قسمت عمده نور را در فواصل زياد ، جذب ميكنند . در ضمن هنگام ذوب SiO2 نيز با مشكلاتي مواجه مي شويم كه تهيه اين ماده را مشكل تر مي كند .
به همين دليل الياف نوري معمولاً با استفاده از تكنيك غير متداول رسوب دهي بخار شيميايي (4) تشكيل مي شوند. در شكل ديگري از اين تكنيك يعني رسوبدهي بخار بيروني (5) مخلوطي از SiCl4, و O2 در شعله CH4 - O2 شعله ور مي شود. يكي از محصولات واكنش SiO2 بي شكل دوده مانند است كه بر سطح خارجي يك ميله شيشه اي ته نشين مي شود. ميله جابجا مي شود وبا حرارت دادن در دماي بالا دوده به شيشـــه محكم مي شود. شيشـــه حاصل به صورت يك تار نازك و فوق العاده خالص در مي آيد. با افزايش كنترل شده ساير هاليدها(براي مثال GeCl4) به شعله ، ضريب شكست مقطع طولي تار حاصل با دقت زياد كنترل مي شود. تركيبات شيشه – سراميك و شيشه هاي تجارتي متنوع ديگر در سراسر جهان به فروش مي رسد . توسعه تكنيكهايي مانند روش رسوب دهي بخار شيميايي و تحقيق در زمينه اساس شيميايي و ساختار شيشه در بسياري از آزمايشگاه هاي دانشگاهي و صنعتي دنبال مي شود . اين تحقيقات تا زماني كه به طرق مختلفي بر زندگي روزمره اثر مي گذارند ، ادامه خواهند يافت .
Glass & Glassmaking J.of chemical Ed. , 68(9), 765-768(1991)
پي نوشت ها :
1. Obsidin
2. Visions
3. Corning
4. Chemical – Vapor Deposition
5. Vapor Deposition Outside
نویسنده : خانم مهندس جعفریان
منبع:http://noorportal.net/1/55/45385.aspx
این مطلب در تاریخ: جمعه 25 اسفند 1391 ساعت: 3:49 منتشر شده است







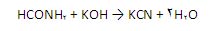



 )
)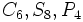 )
)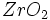 ) و اکسیدهای مختلط همچون اسپنیل (
) و اکسیدهای مختلط همچون اسپنیل (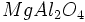 ) ، سیلیکاتهای مختلف مانند
) ، سیلیکاتهای مختلف مانند 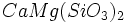 و ...
و ...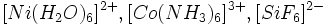 .
. .
. .
. .
.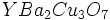 است.
است.